Importação de sêmen aumenta mais de 2.500% no Brasil, diz Anvisa
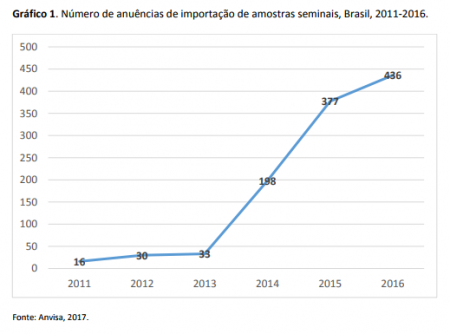
A importação de amostras de sêmen aumentou significativamente – mais de 2.500%, entre 2011 e 2016 no Brasil, conforme aponta o estudo: 1° Relatório de Importação de Amostras Seminais para uso em Reprodução Humana Assistida, produzido pela Agência Nacional de Vigilância Sanitária (Anvisa).
Segundo os laudos médicos recebidos e analisados pela Gerência de Sangue, Tecidos, Células e Órgãos (GSTCO), constantes dos processos de importação, a solicitação das amostras seminais foi realizada em sua maioria por:
- casais heterossexuais, sendo os maridos portadores de problemas de infertilidade, principalmente azoospermia (falta de espermatozoides no sêmen);
- por mulheres solteiras que desejam obter uma gestação independente;
- casais homoafetivos de mulheres.
O grupo que apresentou maior crescimento foi o de casais homoafetivos de mulheres, em 279%, seguido pelo grupo de mulheres solteiras, em 114% e pelo de casais heterossexuais, em 85%, isso no período de 2015 a 2016.
Entre 2014 a 2016, foram dadas anuências para a importação de 1.011 amostras de sêmen. A maioria, 79%, foi destinada a Banco de Células e Tecidos Germinativos – BCTG da região Sudeste, 10% da região Sul, 6% foram enviadas à região Nordeste e 5% aos Bancos da região Centro-Oeste do país.
O Estado de São Paulo importou a maioria das amostras solicitadas à Anvisa – 657 (65%), seguido pelo Estado do Rio de Janeiro com 122 importações – 12%. A maioria dos BCTG encontra-se no Estado de São Paulo, são 47 Bancos.
Os bancos de células e tecidos germinativos – BCTG são os estabelecimentos de saúde do país responsáveis por selecionar, coletar, transportar, registrar, processar, armazenar, descartar e liberar células, tecidos germinativos e embriões, para uso próprio ou em doação, de natureza pública ou privada, para uso em RHA.

As amostras seminais importadas foram provenientes de três Bancos de Sêmen norte-americanos: Fairfax Cryobank, Seattle Sperm Bank e Califórnia Cryobank. Todos de natureza privada, licenciados em nível local e registrados pelo FDA (Food and Drug Administration) – U.S. Department of Health & Human Services.
Os três bancos possuem representantes no Brasil, responsáveis pela intermediação com BCTG nacional recebendo o material e realizando os procedimentos de RHA. Estes representantes estão situados no município de São Paulo.
Segundo esses representantes, o aumento por bancos de sêmen internacionais se deve principalmente a:
- Aumento da divulgação dos bancos internacionais e da disponibilidade da importação deste tipo de material, com um maior número de BCTGs nacionais com acesso aos respectivos serviços
- Maior quantidade de doadores com ampla disponibilidade de acesso às suas características físicas, intelectuais e psicológicas
- Maior disponibilidade de amostras seminais com uma diversidade de testes genéticos realizados
- Maior número de informações disponíveis sobre a família do doador, inclusive com relatos de doenças pré-existentes
- Possibilidade de acesso às fotos dos doadores quando crianças
- Existência de poucos bancos de sêmen no Brasil, que, na maioria das vezes, resulta na dificuldade de se encontrar amostras com as características pretendidas pelos futuros pais.
As amostras seminais importadas no período de 2014 a 2016, foram obtidas de 362 doadores diferentes. Através dos endereços eletrônicos dos bancos de sêmen norte-americanos, foi possível obter as características fenotípicas e informações diversas sobre esses doadores, tais quais: ascendência, cor dos olhos e dos cabelos, formação, profissão, tipo sanguíneo, faixa etária, estilo de vida (signo, religião, hobbies, etc.), perfil psicológico, testes genéticos, informações da família e também fotos de infância e atuais dos doadores.
Segundo a Anvisa, o estudo tem como objetivo levantar elementos para a discussão do aperfeiçoamento dos modelos regulatórios e das políticas de reprodução humana no país. Bem como, dar transparência às ações da Anvisa no cumprimento de sua missão: promover o acesso a produtos e serviços seguros e de qualidade ao cidadão brasileiro.
“Ao longo dos últimos anos, com a tendência de aumento da importação de amostras seminais, a Anvisa tem considerado a necessidade de uma abordagem cada vez mais eficiente no que tange aos trâmites do processo de importação, de forma a integrar análises técnicas que repercutam, de fato, na qualidade e segurança do material biológico e otimizar os trâmites documentais”, explica Joao Batista da Silva Junior, Gerência de Sangue, Tecidos, Células e Órgãos da Anvisa (GSTCO), área responsável pela liberação das importação de amostras de sêmen.
Regulações e normas vigentes
No Brasil, não há Lei específica para disciplinar os aspectos da Reprodução Humana Assistida – RHA.
A Lei n° 11.105, de 24 de março de 2005, conhecida como Lei de Biossegurança, apresenta, critérios para fins de pesquisa e terapia com a utilização de células-tronco embrionárias.
No entanto, existem outros dispositivos normativos definidos pelo Conselho Federal de Medicina – Resoluções CFM n° 2121/2015 e n° 1931/2009 (Código de Ética Médica)
Do ponto de vista de risco sanitário, os BCTGs devem funcionar segundo as determinações da Anvisa por meio da Resolução da Diretoria Colegiada (RDC) n° 23, de 27 de maio de 2011.
Segundo esta RDC, os Bancos de Células e Tecidos Germinativos devem estar devidamente regularizados junto ao órgão local de vigilância sanitária, mediante a submissão periódica de ações de inspeção e fiscalização do cumprimento dos requisitos sanitários, dentre os quais: aspectos de estrutura física, padronização de técnicas laboratoriais, seleção das amostras de doadores e pacientes, testagem laboratorial para detecção de marcadores de infecções transmissíveis e realização de registros documentais.
Vale ressaltar que apenas pessoas jurídicas podem solicitar a anuência de importação desse tipo de material. No caso, exclusivamente, os Bancos de Células e Tecidos Germinativos brasileiros ou o seu representante, na figura do importador.
O prazo para análise e emissão da anuência, definido na legislação, a partir do momento de recebimento de toda a documentação pela área técnica da Anvisa é de 5 dias úteis. No entanto, o tempo médio gasto para este processo técnico tem sido em torno de 3 dias. Leia publicação completa no site da agência.