Anvisa aprova aplicação de CoronaVac em crianças e adolescentes
A decisão da Anvisa foi baseada em estudos realizados em outros países, como China e Chile
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta quinta-feira, 20, por unanimidade, o uso pediátrico da vacina CoronaVac. A autorização de uso emergencial foi concedida especificamente para o público compreendido entre 6 e 17 anos, crianças e adolescentes não imunocomprometidos.
A dose aprovada para este público é a mesma usada para adultos, com um intervalo de 28 dias entre a primeira e a segunda aplicação.
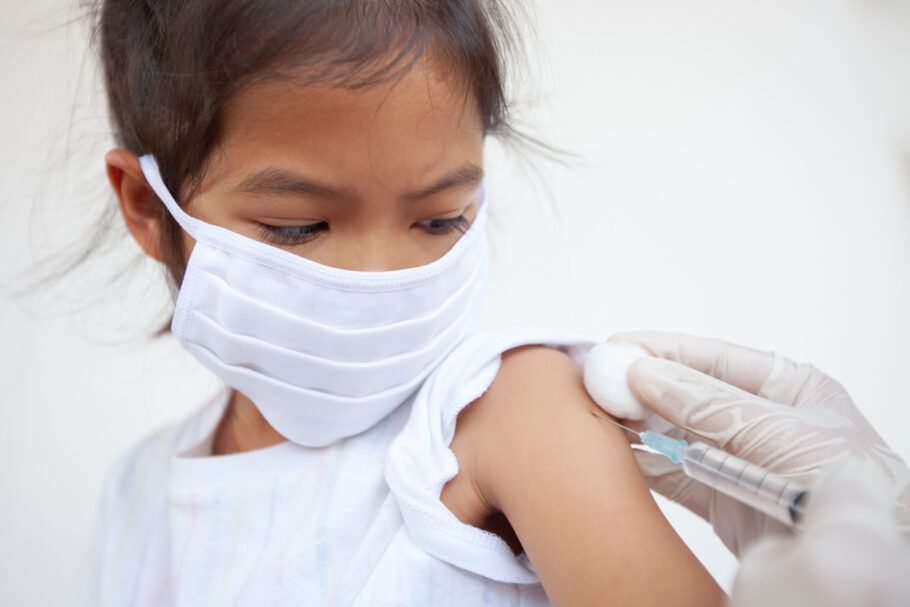
A decisão da Anvisa foi baseada em estudos realizados em outros países, como China e Chile, e apresentados pelo Instituto Butantã no processo.
“As evidências científicas disponíveis até o momento sugerem que há benefícios e segurança para a utilização da vacina na população pediátrica. A autorização levou em conta, também, a necessidade de ampliar as alternativas disponíveis para essa faixa etária. Esclarece-se, no entanto, que a decisão sobre a incorporação no Programa Nacional de Imunizações (PNI) cabe ao Ministério da Saúde”, publicou a Agência.
A Anvisa ainda afirma que, no Brasil, até o momento, a CoronaVac não foi está relacionada a nenhum óbito e os eventos adversos graves causados por ela são considerados raros ou raríssimos.
Segundo a Agência, em outros países em que a CoronaVac já vem sendo aplicada para o público de 2 a 17 anos, os dados demonstram que 86% dos eventos adversos registrados nesta faixa etária são do tipo não graves.
“Ainda assim, a aprovação para o público de 6 a 17 anos no Brasil foi condicionada ao monitoramento constante e comunicação dos eventos adversos que venham a ser registrados e à manutenção de um plano de gerenciamento para minimizar riscos, que contemple a execução de estudos de segurança pós-autorização”, diz a nota.