Aprovado primeiro medicamento doença hepática gordurosa grave
Foi demonstrado que a droga melhora as cicatrizes do fígado em um ensaio clínico envolvendo centenas de pessoas com a condição
A Food and Drug Administration (FDA) dos EUA aprovou o primeiro medicamento para pessoas com um tipo grave de doença hepática gordurosa não alcoólica.
Um ensaio clínico demonstrou que o Rezdiffra melhora as cicatrizes do fígado. O estudo envolveu centenas de pessoas com esteatose hepática não alcoólica, a pior forma da doença causada pelo acúmulo de gordura no fígado.
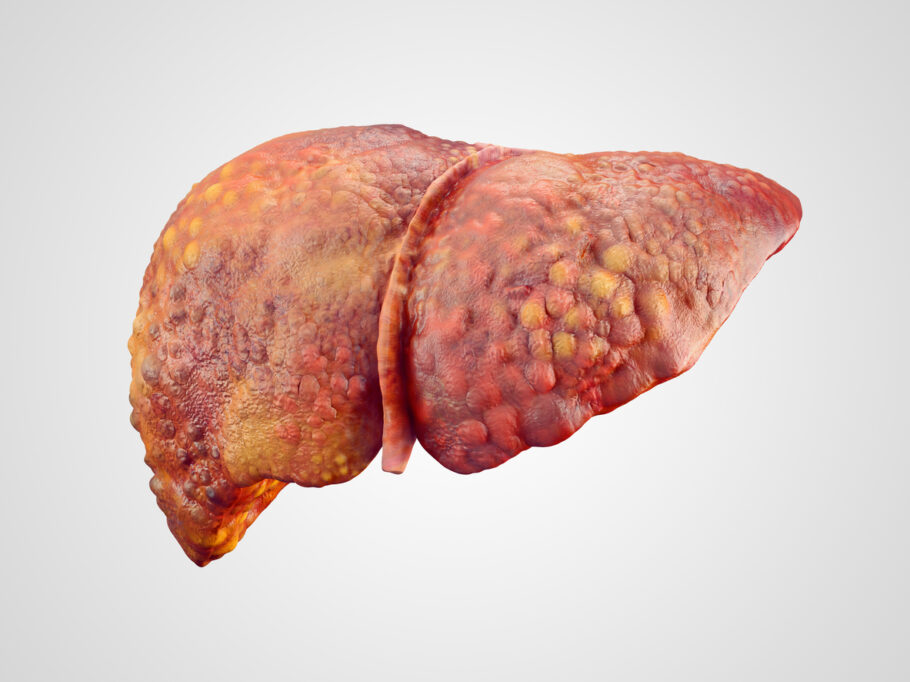
A aprovação do medicamento irá, pela primeira vez, proporcionar uma opção de tratamento para estes pacientes, além de dieta e exercício.
O Rezdiffra, também conhecido pelo nome de molécula resmetirom, é um medicamento oral que visa as causas subjacentes da condição.
O que é e quais os sintomas de esteatose hepática?
A esteatose hepática, também conhecida como “fígado gorduroso”, é uma condição em que há acúmulo excessivo de gordura no fígado.
Normalmente, uma pequena quantidade de gordura é comum no fígado, mas quando esse acúmulo excede 5 a 10% do peso do fígado, é considerado esteatose hepática.
Os sintomas incluem fraqueza, cansaço intenso, amarelecimento da pele ou dos olhos, vasos sanguíneos semelhantes a aranhas e muito mais.
A esteatose hepática que progride para cirrose levará à insuficiência hepática ao longo do tempo, necessitando de um transplante.
Testes com o medicamento
Num ensaio que incluiu 966 pessoas, biópsias hepáticas realizadas aos 12 meses mostraram que uma proporção maior de indivíduos tratados com Rezdiffra alcançou a resolução da sua condição ou uma melhoria nas cicatrizes hepáticas, em comparação com aqueles que receberam o placebo.
Os resultados saíram em fevereiro no New England Journal of Medicine.
Os efeitos colaterais incluíram diarreia e náusea.
A previsão é que o medicamento esteja disponível para pacientes dos EUA em abril.