Covid-19: Anvisa dará autorização temporária para vacina e divulga regras
A agência destacou que a autorização para uso emergencial e temporário da vacina experimental será restrita a um público previamente definido
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou, nesta quarta-feira, 2, que concederá “autorização temporária” para aplicação de vacina contra a covid-19 e divulgou as regras para tal através do “Guia sobre Requisitos Mínimos para submissão de Autorização Temporária de Uso Emergencial, em caráter experimental, de vacinas Covid-19”, também divulgado hoje.
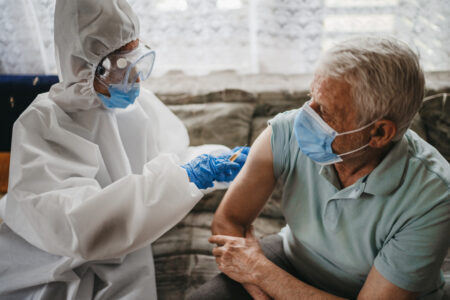
“Para concessão da autorização temporária, a Anvisa analisará caso a caso e a decisão ficará a cargo da Diretoria Colegiada da Agência. Serão considerados dados de estudos não clínicos e clínicos, de qualidade, boas práticas de fabricação, estratégias de monitoramento e controle, resultados provisórios de ensaios clínicos, entre outras evidências científicas. Além disso, a empresa deve apresentar informações que comprovem que a fabricação e a estabilidade são adequadas para garantir a qualidade da vacina”, diz nota divulgada pela Anvisa.
A agência destacou que a autorização para uso emergencial e temporário da vacina experimental será restrita a um público previamente definido. “Essa autorização não substitui o registro sanitário no Brasil. Somente as vacinas com registro sanitário concedido pela Anvisa poderão ser disponibilizadas e comercializadas para toda a população”, ressalta.
- Os sintomas da XEC, nova variante da covid-19; como prevenir?
- Vacina da mpox é aprovada para adolescentes; veja o que diz a OMS
- Anvisa prorroga proibição de produtos à base de fenol em procedimentos estéticos
- Quais vacinas são obrigatórias para viajar para a Europa? Confira regras atualizadas
Para obterem a autorização, as empresas interessadas devem possuir uma Autorização de Funcionamento de Empresa (AFE) emitida pela Anvisa, “com atividade de fabricar ou importar medicamento” e é necessário, ainda, que a vacina seja acompanhada de um Dossiê de Desenvolvimento Clínico de Medicamento (DDCM) aprovado pela Anvisa e que o ensaio clínico na fase 3 esteja em andamento no Brasil.
R$ 1,9 bilhão para compra de vacinas contra covid-19
Ainda nesta quarta-feira, a Câmara dos Deputados aprovou a liberação de R$ 1,9 bilhão para a compra e a produção de 100 milhões de doses da vacina contra a covid-19.
Segundo o governo, dos quase R$ 2 bilhões previstos na medida provisória, R$ 1,3 bilhão serão destinado à farmacêutica britânica AstraZeneca, que está desenvolvendo a vacina em conjunto com a Universidade Oxford, no Reino Unido, para o pagamentos de encomenda tecnológica. A Fiocruz ficará com R$ 95,6 milhões para investimentos e absorção da tecnologia de produção da vacina. Além disso, R$ 522,1 milhões serão repassados à BioManguinhos, laboratório da Fiocruz.
Uma medida provisória passa a valer assim que é publicada, mas precisa do aval da Câmara e do Senado em 120 dias.
A proposta foi aprovada por unanimidade (em votação simbólica) na Câmara, com o apoio até mesmo da oposição a Bolsonaro. O texto segue agora para o Senado, que precisa votar a liberação dos recursos até amanhã.